- 331 Phùng Hưng - P. Tam Phước - Tp. Biên Hoà - Đồng Nai
- Email - candientuminhphuc@gmail.com
Định luật bảo toàn khối lượng là một kiến thức căn bản và rất quan trọng mà các bạn học sinh cần nắm vững khi bắt đầu học môn Hóa học. Nắm chắc định luật này sẽ giúp người học có thể giải các bài tập Hóa học một cách dễ dàng hơn. Hãy cùng Cân điện tử Minh Phúc tìm hiểu chi tiết hơn về định luật bảo toàn khối lượng và thực hành với các bài tập cụ thể!
Trước khi áp dụng công thức vào giải bài tập, các em cần hiểu rõ định nghĩa định luật bảo toàn khối lượng là gì.

Định luật này còn được gọi là định luật Lomonosov - Lavoisier, là một trong những định luật cơ bản trong Hóa học, được phát biểu như sau: Trong một phản ứng hóa học, tổng khối lượng của các chất tham gia phản ứng sẽ bằng tổng khối lượng của các sản phẩm được tạo thành.
Để sử dụng chính xác các công thức trong giải bài tập hóa học, chúng ta cần hiểu rõ bản chất cũng như nội dung của chúng.
Nội dung của định luật bảo toàn khối lượng: Trong mỗi phản ứng hóa học, luôn có sự thay đổi liên kết giữa các nguyên tử, nhưng sự liên kết này chỉ liên quan đến các electron, trong khi số lượng nguyên tử của mỗi nguyên tố được giữ nguyên và khối lượng của các nguyên tử không thay đổi. Vì vậy, tổng khối lượng các chất được bảo toàn.
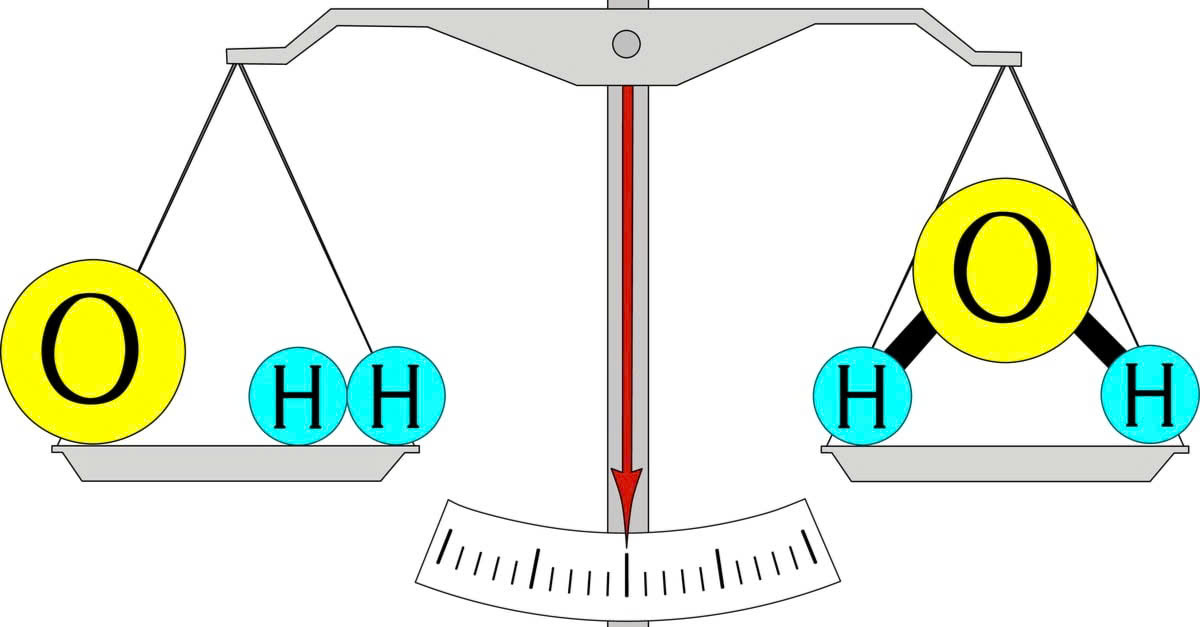
Định luật này còn được gọi là "định luật bảo toàn khối lượng các chất", vì tại cùng một vị trí, trọng lượng tỷ lệ thuận với khối lượng. Lomonosov cũng nhận thấy rằng, việc bảo toàn năng lượng có vai trò quan trọng đối với các phản ứng hóa học.
Ý nghĩa của định luật: Trong mỗi phản ứng hóa học, chỉ có sự thay đổi electron, số nguyên tử của nguyên tố được giữ nguyên và khối lượng của các nguyên tử không thay đổi. Do đó, khối lượng của các chất được bảo toàn.
Cách tính định luật bảo toàn khối lượng như sau:
Giả sử có phản ứng giữa A + B tạo thành C + D, công thức định luật bảo toàn khối lượng được viết như sau: mA + mB = mC + mD
Ví dụ cụ thể để bạn dễ hiểu: Bari clorua + natri sunfat tạo thành bari sunfat + natri clorua. Khi đó, ta có công thức định luật bảo toàn khối lượng như sau:
mbari clorua + mnatri sunphat = mbari sunphat + mnatri clorua
.jpeg)
Áp dụng định luật bảo toàn, ta có kết quả: Trong một phản ứng có n chất, nếu biết khối lượng của (n – 1) chất, ta có thể tính được khối lượng của chất còn lại.
Để giúp bạn áp dụng định luật bảo toàn khối lượng một cách thành thạo nhất, hãy thực hiện các bài tập sau:
Bài 1:
Bài 2:
Trong phản ứng hóa học sau: Bari clorua + Natri sunfat tạo thành bari sunfat + natri clorua. Cho biết khối lượng của natri sunfat Na2SO4 là 14,2 gam, khối lượng của bari sunfat BaSO4 và khối lượng natri clorua NaCl lần lượt là: 23,3 g và 11,7 g.
Tính khối lượng của bari clorua BaCl2 đã tham gia phản ứng.
Bài 3:
Đốt cháy hoàn toàn 9g kim loại magie Mg trong không khí, thu được 15g hỗn hợp chất magie oxit MgO. Magie cháy sẽ phản ứng với oxi O2 trong không khí.
Bài 4:
Đốt cháy m(g) cacbon cần 16g oxi, thu được 22g khí cacbonic. Tính m.
Bài 5:
Đốt cháy 3,2g lưu huỳnh S trong không khí, thu được 6,4g lưu huỳnh đioxit. Tính khối lượng oxi đã tham gia phản ứng.
Bài 6:
Đốt cháy m(g) kim loại magie Mg trong không khí, thu được 8g hợp chất magie oxit (MgO). Khối lượng magie Mg tham gia bằng 1,5 lần khối lượng oxi (không khí) tham gia phản ứng.
Bài 7:
Đá đôlomit (hỗn hợp của CaCO3 và MgCO3), khi nung nóng tạo ra 2 oxit là canxi oxit CaO, magie oxit MgO và khí cacbon đioxit.
Bài 8:
Giải thích vì sao khi nung thanh sắt thì khối lượng thanh sắt tăng lên, còn khi nung nóng đá vôi thì khối lượng lại giảm đi?
Bài 9:
Khi hòa tan cacbua canxi (CaC2) vào nước (H2O), thu được khí axetylen (C2H2) và canxi hiđroxit (Ca(OH)2).
Bài 10:
Khi cho Mg tác dụng với axit clohiđric, khối lượng magie clorua (MgCl2) nhỏ hơn tổng khối lượng Mg và axit clohiđric khi tham gia phản ứng. Điều này có phù hợp với định luật bảo toàn khối lượng hay không? Giải thích.
Định luật bảo toàn khối lượng phát biểu rằng: Trong một phản ứng hóa học, tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các chất sản phẩm.
Định luật do Antoine Lavoisier, nhà hóa học người Pháp, phát hiện vào thế kỷ 18.
Áp dụng cho mọi phản ứng hóa học diễn ra trong hệ kín, nghĩa là không có chất ra vào môi trường bên ngoài.
.jpeg)
Vì trong phản ứng hóa học không có hạt mới được sinh ra hoặc mất đi, các nguyên tử chỉ tái sắp xếp để tạo thành chất mới, nên tổng khối lượng không đổi.
Không hoàn toàn. Trong phản ứng hạt nhân, khối lượng có thể thay đổi do một phần chuyển thành năng lượng (theo E = mc²), nên định luật bảo toàn khối lượng truyền thống không còn chính xác.
Cần một hệ kín, không để chất bay hơi, cháy thoát ra ngoài hoặc dung dịch bị tràn.
Ta có thể dùng cân để đo khối lượng trước và sau phản ứng (ví dụ: cho đá vôi phản ứng với axit trong bình kín) → kết quả khối lượng không đổi.
Dùng để:
Lập phương trình hóa học hợp lý
Tính khối lượng chất tham gia, sản phẩm
Tính hiệu suất phản ứng
.jpeg)
Vẫn đúng, nếu hệ được đậy kín. Nếu không kín, khí bay ra ngoài thì khối lượng giảm nên không thể áp dụng trực tiếp.
Có. Ví dụ:
Nếu 10 g CaCO₃ phân hủy tạo CaO và CO₂, thì tổng khối lượng sản phẩm cũng phải bằng 10 g (CaO + CO₂ = 10 g).
Hy vọng với bài viết này, cân điện tử Minh Phúc đã giải thích chi tiết về định luật bảo toàn khối lượng, cách tính, ý nghĩa và một số dạng bài tập ứng dụng. Nếu những nội dung trên hữu ích và giúp bạn áp dụng để giải các bài tập chính xác, nhanh chóng, hãy bình luận bên dưới nhé. Chúc các bạn học tốt.